Ковалентті байланыс. Оның қасиеті. Ковалентті байланыс түзілуінің донорлы - акцепторлы механизмі 2-сабақ (Химия, 10 сынып, I тоқсан)
Пән: Химия
Ұзақ мерзімді жоспар бөлімі: Ковалентті байланыс. Ковалентті байланыстың қасиеттері
Сабақ тақырыбы: Ковалентті байланыс. Оның қасиеті. Ковалентті байланыс түзілуінің донорлы - акцепторлы механизмі 2-сабақ
Осы сабақта қолжеткізілетін оқу мақсаттары (оқу бағдарламасына сілтеме): Оқушы:
- коваленттік байланыстың "нүктелер мен айқыштар" диаграммасын сала біледі
- қос және үш еселі байланыстың түзілуін түсінеді;
- ковалентті байланыстың қасиеттерін сипаттайды
-"нүктелер мен айқыштар" диаграммасын сала білу
- коваленттік байланыстың түзілу механизмін түсіну
Сабақ мақсаттары: 10.1.4.1 донор-акцепторлы және алмасу механизмі бойынша ковалентті байланыстың түзілуін түсіндіру;
10.1.4.2 қос және үш еселі байланыстың түзілуін түсіндіру;
10.1.4.3 ковалентті байланыстың қасиеттерін сипаттау;
Ұйымдастыру.
Тақырыпты проблемалық сұрақтар арқылы бастау.
1.Табиғатта заттар қандай түрде кездеседі?
2.Металл, бейметалл атомдарының құрылыс ерекшелігі неде?
3. Инертті элементтердің айырмашылығы неде?
4.Аяқталған және аяқталмаған электрондық қабат нені білдіреді?
Жаңа сабақ материалын түсіндіру:
1.«Ашық және жабық сұрақтар» ( сыни тұрғыдан ойлау стратегиясы)
Сутегі молекуласында ков. байланыстың түзілуін,«нүктелер мен айқыштар» диаграммасы арқылы түсіндіру.
- Сутектің электрондық конфигурациясын жазайық.
- Сутек атомы тұрақты ма ?
- Не себептен сутек табиғатта атом түрінде кездеспейді?
- Сутек атомы тұрақтылыққа қалай жете алады?
-Сутек молекуласының «айқыш пен нүкте» арқылы жұппен суретін салып көріңіздерші.
Оқушылардың жауаптарын талқылау , тақтада тексеру.
2. Суреттер бойынша оқушыларды жұптарға бөлу.
( оқушыларды топтастыру арқылы, талқылау жұмысы негізінде тақырыпты игеруге мүмкіндік жасау)
Топтық жұмыс:
А-деңгей тапсырмасы
1 топ - хлор
2 топ - оттегі
3 топ - азот
молекулаларындағы байланысты «нүктелер мен айқыштар» диаграммасы арқылы көрсетіңдер.
Бағалау критериялары:
1.Элементтердің сыртқы энергетикалық деңгейіндегі электрондарын дұрыс көрсете алды.
2. Электрондарды «айқыш пен нүкте» арқылы көрсетті.
3. Ортақ жұп электрондарды дұрыс көрсетті.
Топтар бірін-бірін тексеріп бағалайды( егер жазған диаграмаларымен дұрыс деп келіссе, онда жасыл карточкаларын көтереді, келіспесе қызыл).
3. « Араласып кеткен оқиғалар» ( сыни тұрғыдан ойлау стратегиясы) - оқушылар сөз қиындыларынан ковалентті байланыс ережесін құрастырады.
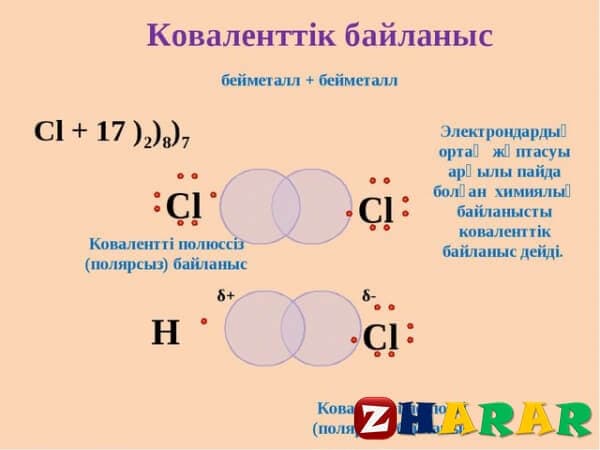
ковалентті байланыс
Ортақ электрон жұбы арқылы түзілген байланыс ковалентті байланыс деп аталады.
4. Тұз қышқылының «нүктелер мен айқыштар» диаграммасын жазыңыздар.Бір оқушы өз ұсынысы бойынша тақтаға шығып түсіндіреді. Сынып оқушылары бірге талдап ,өздерінің жауаптарын слайд бойынша дұрыс жауап арқылы тексереді
5. «Ашық және жабық сұрақтар» ( сыни тұрғыдан ойлау стратегиясы)
Ковалентті байланыс полюсті және полюссіз деп екіге бөлінеді.
- Сіздер жазған қосылыстарды полюсті және полюссізге жіктеп көріңіздерші.
- Қалай жіктер едініздер?
- Не себептен?
- Ковалентті полюсті және полюссіз байланыстарды салыстырыңыздар. Айырмашылығы неде?
-Ұқсастығы неде?
Ковалентті полюссіз байланыс электртерістілігі бірдей атомдар арасында түзіледі. (Н2, О2, С12). Молекуладағы атомдар өзара байланысқанда электрон бұлттары жақындап,өзара қаптасады.
Атомдардың өзіне электрондар тарту қабілетін электртерістілік деп атайды.
Атомдар жақындасқанда олардың электрондық бұлттары бүркесіп,ядролардың арасындағы кеңістікте максимал электрон тығыздығы бар электрон бұлттары түзіледі.Ортақ ядролардың тығыз теріс аймаққа тартылуы оларды жақындастырып,тұрақты сутек молекуласы түзіледі де,энергия ұтымы болады.
Қарама-қарсы спиндері бар жұптаспаған электрондар өзара қосылуы арқылы ковалентті полюссіз байланыс түзіледі.Ол былай жазылады.......
Ұзақ мерзімді жоспар бөлімі: Ковалентті байланыс. Ковалентті байланыстың қасиеттері
Сабақ тақырыбы: Ковалентті байланыс. Оның қасиеті. Ковалентті байланыс түзілуінің донорлы - акцепторлы механизмі 2-сабақ
Осы сабақта қолжеткізілетін оқу мақсаттары (оқу бағдарламасына сілтеме): Оқушы:
- коваленттік байланыстың "нүктелер мен айқыштар" диаграммасын сала біледі
- қос және үш еселі байланыстың түзілуін түсінеді;
- ковалентті байланыстың қасиеттерін сипаттайды
-"нүктелер мен айқыштар" диаграммасын сала білу
- коваленттік байланыстың түзілу механизмін түсіну
Сабақ мақсаттары: 10.1.4.1 донор-акцепторлы және алмасу механизмі бойынша ковалентті байланыстың түзілуін түсіндіру;
10.1.4.2 қос және үш еселі байланыстың түзілуін түсіндіру;
10.1.4.3 ковалентті байланыстың қасиеттерін сипаттау;
Ұйымдастыру.
Тақырыпты проблемалық сұрақтар арқылы бастау.
1.Табиғатта заттар қандай түрде кездеседі?
2.Металл, бейметалл атомдарының құрылыс ерекшелігі неде?
3. Инертті элементтердің айырмашылығы неде?
4.Аяқталған және аяқталмаған электрондық қабат нені білдіреді?
Жаңа сабақ материалын түсіндіру:
1.«Ашық және жабық сұрақтар» ( сыни тұрғыдан ойлау стратегиясы)
Сутегі молекуласында ков. байланыстың түзілуін,«нүктелер мен айқыштар» диаграммасы арқылы түсіндіру.
- Сутектің электрондық конфигурациясын жазайық.
- Сутек атомы тұрақты ма ?
- Не себептен сутек табиғатта атом түрінде кездеспейді?
- Сутек атомы тұрақтылыққа қалай жете алады?
-Сутек молекуласының «айқыш пен нүкте» арқылы жұппен суретін салып көріңіздерші.
Оқушылардың жауаптарын талқылау , тақтада тексеру.
2. Суреттер бойынша оқушыларды жұптарға бөлу.
( оқушыларды топтастыру арқылы, талқылау жұмысы негізінде тақырыпты игеруге мүмкіндік жасау)
Топтық жұмыс:
А-деңгей тапсырмасы
1 топ - хлор
2 топ - оттегі
3 топ - азот
молекулаларындағы байланысты «нүктелер мен айқыштар» диаграммасы арқылы көрсетіңдер.
Бағалау критериялары:
1.Элементтердің сыртқы энергетикалық деңгейіндегі электрондарын дұрыс көрсете алды.
2. Электрондарды «айқыш пен нүкте» арқылы көрсетті.
3. Ортақ жұп электрондарды дұрыс көрсетті.
Топтар бірін-бірін тексеріп бағалайды( егер жазған диаграмаларымен дұрыс деп келіссе, онда жасыл карточкаларын көтереді, келіспесе қызыл).
3. « Араласып кеткен оқиғалар» ( сыни тұрғыдан ойлау стратегиясы) - оқушылар сөз қиындыларынан ковалентті байланыс ережесін құрастырады.
ковалентті байланыс
Ортақ электрон жұбы арқылы түзілген байланыс ковалентті байланыс деп аталады.
4. Тұз қышқылының «нүктелер мен айқыштар» диаграммасын жазыңыздар.Бір оқушы өз ұсынысы бойынша тақтаға шығып түсіндіреді. Сынып оқушылары бірге талдап ,өздерінің жауаптарын слайд бойынша дұрыс жауап арқылы тексереді
5. «Ашық және жабық сұрақтар» ( сыни тұрғыдан ойлау стратегиясы)
Ковалентті байланыс полюсті және полюссіз деп екіге бөлінеді.
- Сіздер жазған қосылыстарды полюсті және полюссізге жіктеп көріңіздерші.
- Қалай жіктер едініздер?
- Не себептен?
- Ковалентті полюсті және полюссіз байланыстарды салыстырыңыздар. Айырмашылығы неде?
-Ұқсастығы неде?
Ковалентті полюссіз байланыс электртерістілігі бірдей атомдар арасында түзіледі. (Н2, О2, С12). Молекуладағы атомдар өзара байланысқанда электрон бұлттары жақындап,өзара қаптасады.
Атомдардың өзіне электрондар тарту қабілетін электртерістілік деп атайды.
Атомдар жақындасқанда олардың электрондық бұлттары бүркесіп,ядролардың арасындағы кеңістікте максимал электрон тығыздығы бар электрон бұлттары түзіледі.Ортақ ядролардың тығыз теріс аймаққа тартылуы оларды жақындастырып,тұрақты сутек молекуласы түзіледі де,энергия ұтымы болады.
Қарама-қарсы спиндері бар жұптаспаған электрондар өзара қосылуы арқылы ковалентті полюссіз байланыс түзіледі.Ол былай жазылады.......
Толық нұсқасын 30 секундтан кейін жүктей аласыз!!!
Әлеуметтік желілерде бөлісіңіз:
Facebook | VK | WhatsApp | Telegram | Twitter
Қарап көріңіз 👇
Пайдалы сілтемелер:
» Туған күнге 99 тілектер жинағы: өз сөзімен, қысқаша, қарапайым туған күнге тілек
» Абай Құнанбаев барлық өлеңдер жинағын жүктеу, оқу
» Дастархан батасы: дастарханға бата беру, ас қайыру

